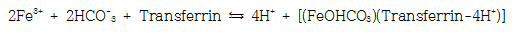|

|
 |
|
|
한국건강관리협회 조한익
1. 들어가는 말철(Fe, iron)은 인체에서 산소 운반, 산화성 대사(oxidative metabolism), 세포 증식, 촉매 작용 등에 관여 하는 필수 중금속이다. 적혈구의 혈색소 형성에 필수 요소이지만 동시에 포유류 세포에 강력한 독성을 나타내기도 한다. 질병을 일으키는 많은 미생물에게도 필요한 영양소로 감염질환에서 인체는 세균에 철이 공급되는 것을 낮추는 방어기전을 작동하기도 한다. 인체에서 철은 적정범위내의 농도로 유지되어야하고 과잉이나 결핍되면 질병을 유발할 수 있다. 철 대사는 여러 장기와 조직, 많은 유전자와 단백질이 관여하는 복잡한 대사 작용이고 이들의 상호작용이 철의 항상성 유지에 중요하다. 관련 유전자와 이들의 다형성 대립유전자를 알아내는 것은 관련 단백질의 철 대사 작용에서 역할을 이해하는데 길잡이가 된다. 인체의 다른 물질 대사와 달리 철 대사의 중요한 특징은 인체에서 철이 배출되는데 특별한 기전이 없고 피부나 장세포 등이 떨어져 나가는데 묻어서 소실된다는 것이다. 철 손실이 많은 가임 여성의 경우도 월경 시 출혈 혈액 양에 따라 철이 소실되기 때문에 철 배출량을 조절할 수 없다. 그래서 인체의 철의 양을 조절하는 유일한 기전은 흡수과정이다. 그래서 철 흡수량이 배출량에 맞추어 엄격하게 조절되어야 한다. 철 대사를 연구하는 철학(鐵學, ironomics)은 철의 항상성 유지 기전을 밝혀 철 결핍이나 철 부하상태, 그리고 헌혈 같은 인공적 출혈에 대한 이해를 높여 관련 질병의 진단과 치료, 그리고 헌혈자 선택 지침 등에 필요한 기초자료를 제공한다. 인체 철 대사의 개괄적인 흐름은 음식에 있는 철이 장에서 흡수되고 혈액으로 유출되어 간, 골수, 비장 등으로 운반되어 활용되거나 저장된다. 적혈구의 혈색소에 있는 철을 비롯한 각 조직과 세포에서 있는 철은 순환 사이클을 거쳐 재활용된다. 피부세포가 탈락되거나 출혈되어 소실되는 철은 음식으로 보충되어야 한다. 철은 십이지장과 공장(jejunum)의 상부 장세포(enterocyte)에서 흡수된다. 장세포에서 페리틴(ferritin)으로 저장되기도 하지만 인체의 요구에 따라 혈액으로 유출되어 트랜스페린(transferrin)과 결합하여 신체 각 조직으로 운반되어 이용된다. 골수, 간, 비장 등으로 운반되어 적혈구조혈과 각종 효소 생산에 쓰이고 수명이 다 된 적혈구의 혈색소 철은 비장, 간 등의 대식세포에서 재활용 과정을 거친다. 이 과정은 각 단계마다 철 조절 호르몬, 운반체, 수용체, 산화 환원 효소 등이 관여하여 철의 항상성을 유지하도록 한다. 대표적인 물질이 간에서 생산되는 헵시딘(hepcidin)이란 철 조절 호르몬이다. 철은 필수 영양소이지만 한편 인체에 해를 줄 수 있어 이 철 대사 과정의 기전에 대한 이해를 높여야한다. 2가 철(ferrous, Fe2+)이 과산화수소(H2O2)를 만나면 펜톤 반응(Fenton reaction)을 일으켜 독성의 산소기를 다량 만들 수 있어 이를 최소화시키는 생리기전에 대한 이해가 필요하다. 또한 2가 철과 3가 철(ferric, Fe3+)이 각 단계마다 산화-환원 작용으로 변화하는데, 음식물에는 3가 철, 장세포로 흡수는 2가 철 상태로, 장세포에서 페리틴과 결합할 때는 3가 철, 페로폴틴(ferroportin)을 따라 혈액으로 유출될 때는 2가 철, 혈액에서 트랜스페린과 결합할 때는 3가 철이 되어야한다. 이 과정에 관여하는 산화–환원 효소들에 대한 이해가 필요하다. 최근 발전된 철 대사에 대한 지견을 정리한 목적은 우리나라에 아직도 가임 여성의 8% 정도가 철결핍빈혈 환자이고 우리나라의 모든 사회 환경이 선진국 수준에 도달했는데도 철결핍환자가 감소되지 않는 문제를 해결하기 위해 철 대사에 대한 이해를 넓혀 보자는 의도이다. 먼저 아래 철 결핍 발생의 원인을 살펴보면 대부분 예방이 가능한 데도 이를 소홀히 한 점이 없는지도 살펴볼 필요가 있다. 표 1. 철 결핍의 원인
2. 인체 철의 분포와 임신관련 철의 분포 변화남자는 약 4,000 mg의 철을 가지고 있다. 2,500 mg은 적혈구에 있고 1,000 mg은 비장, 간의 대식세포에 있다. 나머지는 미오글로빈(myoglobin), 시토크롬, 철 단백 등에 있다. 혈장에는 단지 3 mg이 트랜스페린 등과 결합되어 있어 철을 필요로 하는 세포로 공급한다. 철을 체외로 배설하는 경로가 없고 탈락되는 피부, 장세포들을 따라 체외로 소실된다. 소실되는 철은 장 흡수로 보충된다. 따라서 철 재활용은 철 항상성 유지에 가장 중요한 역할을 한다. 월경을 하는 여성에서는 출혈로 다량의 철이 소실된다. 그래서 가임 여성은 혈색소와 페리틴의 정상범위가 다른 사람에 비하여 낮아도 철 결핍이라 하지 않고 정상범위로 인정한다. 임신 여성의 경우는 더 복잡하지만 철 보충이 건강에 도움이 된다. 유아나 소아 등 성장기에는 더 많은 철이 필요하다. 표 2. 인체 철의 분포
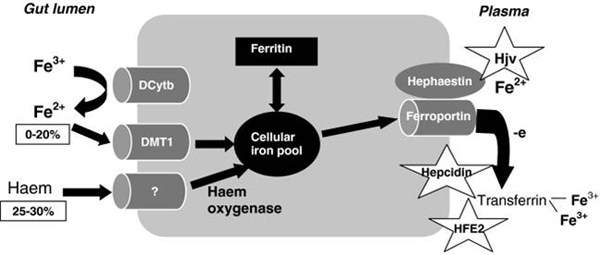
남자: 4,000 mg (3,000 – 5,000 mg) 3. 음식에서의 철철은 지구에서 양이 가장 많은 금속 물질이지만 살아있는 포유류 세포에서 강한 독성을 나타내고 생체 이용률이 낮다. 그래서 쌀에 영양소를 보충하여 철을 공급하려는 시도가 있다. 전통적인 교배법과 유전자조작법 등 단시간 내에 성과를 보는 방법으로 철 성분이 많이 포함된 쌀을 생산하는 것이다. 무기물이 풍부한 곡물을 생산하는 방법은 첫째, 무기물비료를 사용하여 토양에서 무기물의 용해와 이용률을 높이는 방법이고, 둘째는 무기물이 풍부한 곡물을 개발하고 식용 조직에 무기물이 풍부하게 포함되도록 하는 것이다. 유전자 삽입술로 철이 풍부한 쌀 품종을 개발하는 노력도 하고 있다. Indica 쌀 계통에 soybean ferritin 유전자를 삽입하여 철 성분이 높은 쌀을 만들기도 했다. 그러나 유전자 조작 식품에 대한 우려와 거부감 때문에 보통 식품에 대한 철 함량 정보가 더 유용하게 활용될 수도 있다. 여러 가지 식품에서의 철 함량과 철의 흡수에 영향을 주는 조건에 대한 이해가 필요하다. 더구나 혈색소증이나 철 부하 질환 환자에게는 철 강화 식품이 해가 될 수도 있어 일률적으로 철 강화 식품을 활용할 수도 없다. 4. 장에서 철의 흡수보통 식단에는 약 15 mg의 철이 포함되어 있고 그중 10%가 헴에 있고 나머지는 비헴철과 이온형태로 있다. 이 중 10%만 장에서 흡수된다. 철은 십이지장과 공장 상부에서 주로 흡수된다. 이들 소장의 장세포에는 여러 종류의 철 흡수단백이 있고 이들에 의해 이온 형태(2가 철, 3가 철)의 철과 헴철을 흡수한다. 헴철은 혈색소, 미오글로빈 같은 헴단백(hemoprotein)과 연계되어 있고 비헴철은 페리틴 등 여러 가지 저장 단백과 연계되어있다. 위액의 산성 환경에서 헴은 헴단백에서 유리된다. 비타민 C나 다른 산성 물질들이 철 흡수를 촉진하는 것도 산성 환경을 만들어 주기 때문이다. 헴철의 흡수기전은 두 가지로, 장세포에 있는 수용체에 붙어 흡수되든가 헴자체가 세포내이입(endocytosis)에 의해 흡수되고 불안정 철풀(labile iron pool, LIP)로 모아진다. 분해되지 않은 헴은 직접 혈액으로 흡수될 수도 있다. 헴철의 흡수가 많으면 인체 저장철이 증가하여 제2형 당뇨병 발생 위험이 커진다. 이에 비하여 식이철(비헴철)과 철보충제 섭취는 제2형 당뇨병 발생 위험과 관계없다. 비헴철은 음식으로 3가 철 상태로 섭취되고 장세포 표면에 있는 철환원효소(ferric reductase)인 십이지장 시토크롬 B (duodenal cytochrome B, DCYTB)가 전자를 공급해 주어 2가 철이 된 다음 장세포 표면에 있는 divalent metal transporter 1 (DMT1)에 의해 장세포 내로 흡수된다.
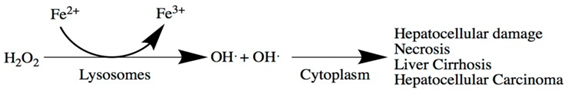
인체의 철 수요가 낮으면 철은 장세포에 세포내 저장철 형태인 페리틴으로 저장된다. 페리틴은 중쇄와 경쇄의 두 가지 하부 단위로 되어 있어 이것들이 둥근 공간을 만들고 이 공간에 4500 개까지 철이온을 품을 수 있다. 장세포는 수명이 짧아 탈락되고 며칠 내에 새 세포로 대치된다. 따라서 장세포에 보관된 페리틴도 떨어져 나간다. 그러나 철 수요가 높아지면 흡수된 2가 철은 장세포 기저측막(basolateral membrane)을 통하여 혈액으로 유출된다. 이 단계는 2가 철 수출 단백인 ferroportin 1 (FPN1)에 의해 장세포의 철이 얼마나 혈액으로 유출되어 필요한 장소로 가느냐가 조절된다. FPN1의 발현은 간 호르몬인 헵시딘에 의해 엄격하게 규제된다. 2가 철 상태로 장내세포로 들어온 불안정 철풀(LIP)의 2가 철은 리소좀에서 과산화수소와 만나 독성을 가진 수산화물(OH)과 활성산소(reactive oxygen species)를 만들어 독성을 나타내 주위의 핵, DNA, 단백, 지질 등을 파괴시킬 수 있다. 그래서 철 과부하 상태는 간세포의 손상과 괴사를 일으키고 여기에 섬유화가 일어나 간 경변이 되고 나아가서 간 세포암이 되는 병 진행의 단초가 될 수 있다.
헴철은 육식동물과 잡식동물의 중요한 영양 자료이다. 헴철은 채소나 곡물로부터 얻은 비햄철보다 쉽게 흡수된다. 대부분 헴철은 장의 상부 시작 부위에서 흡수되고 말단부로 갈수록 점차 흡수력이 감소된다. 5. 장세포에서 혈액으로 철 유출음식에 있는 철이 장세포로 흡수되면 그다음 단계는 세포내의 철풀에 따라 결정된다. 철은 장세포에서 혈액으로 유출되는데 FPN1이 관여한다. 이 FPN1은 대식세포에 다량 존재하는 매우 특별한 철 유출 단백이다. FPN1 단백의 발현은 세포내 철에 의해 유도되고 헵시딘에 의해 억제된다. 헵시딘은 FPN1단백에 붙어 세포내로 들어가고 리소좀에서 파괴된다. 결과적으로 장세포나 대식세포로부터 철 유출이 억제되어 십이지장세포에서 철 흡수를 감소시킨다. FNP1 유전자가 결손 되면 장세포와 대식세포에서 철 유출을 막아 철이 장세포와 대식세포에 쌓인다. 철이 혈액으로 들어가면 세룰로플라스민(ceruloplasmin) 같은 철산화효소(ferroxidase)에 의해 2가 철이 3가 철로 산화되어야 트랜스페린과 결합할 수 있다. 철산화효소는 세포표면의 FPN1을 안정화시키는데 철산화효소의 작용이 없으면 FPN1은 세포내로 들어와 파괴된다. 추가로 간에서 생산되는 혈액 내 동운반 단백인 세룰로플라스민도 철산화작용을 한다. 세룰로플라스민 결핍증에서 빈혈은 세포철의 유출 장애 때문이다. 6. 장에서의 철 대사 이상장에서 일어날 수 있는 철 대사이상으로는 위장관을 통한 철 손실의 증가가 가장 빈번하다. 위장관 출혈이 있으면 철 손실이 일어나고 철결핍빈혈을 일으킨다. 위장관 출혈은 위십이지장궤양, 위암, 염증성장질환 등에서 일어난다. 장 말단부위에서 출혈은 대장암, 치질이 원인 질환이다. 식도에서는 식도정맥류, 식도염, 식도암 등이 출혈을 일으킨다. 십이지장충은 전 세계적으로 수억 명이 감염되어 있어 철결핍빈혈의 주요 원인이다. 이 기생충은 장벽에 수년 간 붙어 있으면서 한 마리당 하루 약 0.05 – 0.5 mL의 혈액을 빨아먹는다. 장에서 철흡수장애도 일어난다. 위절제하면 위액분비가 줄어들어 위장관의 pH가 알카리쪽으로 기울기 때문에 철 흡수가 장애를 받는다. 위점막위축으로 철 흡수를 감소시키고 위십이지장궤양을 일으켜 출혈로 철 손실을 일으킨다. 약물로는 양성자펌프(protom pump)억제제와 항산제 등이 pH를 높여 장에서 철 흡수를 감소시킨다. 7. 철 운반과 세포의 철 흡수트랜스페린은 혈장에서 철을 운반하는 단백이다. 트랜스페린 결합부위의 20 – 40%는 3가 철로 채워져 있다. 트랜스페린의 진단적 가치는 커서 철결핍과 철부하의 진단에 이용된다. 철포화지수는 철부하의 중요한 지표이다. 혈액 내에서 철이 트랜스페린에 의해 운반되려면 흡수된 2가 철이 3가 철로 산화되어야 한다. 3가 철은 철에 친화력이 강한 트랜스페린에 결합되어 인체내 철이 필요한 곳으로 운반된다. 보통 정상 생리 상태에서는 트랜스페린의 30%가 철과 결합되어 채워져 있다. 이런 상태는 트랜스페린 비결합철(non-transferrin-bound iron, NTBI)이 갑자기 증가하여 조직에 침투하여 산화손상을 일으킬 수 있는 상황을 완충시킬 수 있다. 철과 트랜스페린은 그림 3과 같이 결합한다.
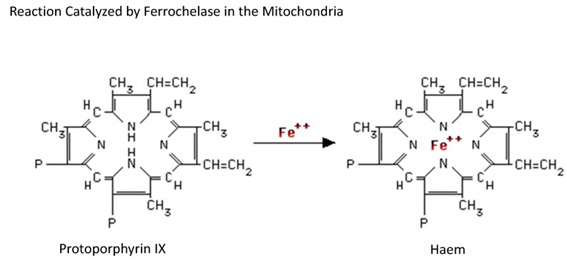
인체의 모든 세포는 트랜스페린으로 부터 철을 얻는다. 트랜스페린은 중성 pH에서 철과 강한 친화력을 갖는다. 트랜스페린은 원형질막의 트랜스페린수용체(transferrin receptor)를 통하여 철을 공급한다. 적혈구 전구세포들도 트랜스페린 수용체를 통해서 철을 얻는다. 3가 철과 트랜스페린의 복합체는 트랜스페린 수용체에 붙어서 endosomal recycling vesicle에 의해 세포내로 들여온다. 세포내로 내재화되고 소포(vesicle)의 pH가 5.5가 되면 철이 유리된다. 철이 떨어져나가고 남은 불완전 트랜스페린-트랜스페린 수용체 복합체는 세포표면으로 이동하여 이곳의 pH가 중성이 되면 트랜스페린은 트랜스페린 수용체에서 분리되어 혈액으로 되돌아가 다시 철 운반 기능을 하게 된다. 추가로 트랜스페린 수용체는 떨어져 나와 가용(soluble) 형태의 가용성트랜스페린수용체(soluble transferrin receptor, sTfR)로 세포외액과 혈액에 존재한다. 8. 가용성트랜스페린 수용체(soluble transferrin receptor, sTfR)트랜스페린수용체(transferrin receptor, TfR)는 세포의 원형질막에 붙어있는데 여기에 트랜스페린이 부착한다. 수용체에 부착된 트랜스페린은 세포내로 들어가 세포질 안에 철을 내려 놓는다. 이렇게 공급된 철이 혈색소형성 등에 이용된다. 원형질막에 붙어있는 TfR의 일부 구조가 떨어져 나와 혈청에 있는 것이 가용성트랜스페린수용체(soluble transferrin receptor, sTfR)이다. 철결핍빈혈에서는 많은 철을 공급 받을 수 있도록 TfR가 증가하고 따라서 sTfR도 증가한다. 철결핍빈혈의 진단에서 중요한 기준이 저장철의 감소 여부이고 이는 골수검사로 제작한 도말표본을 철염색하여 판단할 수 있다. 이런 번거로운 작업 대신에 혈청 페리틴을 측정한다. 페리틴은 저장철의 양을 잘 나타내지만 급성기 반응물질(acute phase reactant)이어서 염증 질환, 간염 등 감염질환, 낭성섬유증 등 만성질환, 암, 자가면역질환, 위축성 위염이 있는 제2형당뇨병 등에서도 증가한다. 따라서 이런 병의 환자에서는 철결핍빈혈이 있다 해도 페리틴이 오히려 증가될 수 있다. 그런데 sTfR은 염증등 질환의 영향을 받지 않으면서 저장철 상태에 따라 증가하기 때문에 철결핍빈혈 진단에 도움이 된다. 9. 골수에서의 철 대사인체 철의 3분의 2가 혈색소 철이다. 따라서 적혈구조혈이 일어나는 골수가 가장 중요한 철의 수요기관이다. 인체의 모든 유핵세포가 원형질막에 철-트랜스페린 결합체(Fe-Tf)에 친화성이 강한 트랜스페린수용체 1 (transferrin receptor1, TfR1)을 가지고 있다. TfR1의 농도는 해당 세포의 철 요구도에 비례한다. 적아구에는 TfR1가 아주 많이 있고 간세포에는 상대적으로 적다. 트랜스페린결합철(transferrin-bound iron, TBI)은 수용체 중개 세포 내 섭취(receptor mediated endocytosis)로 세포 안으로 들어간다. 처음에는 TBI가 세포막의 TfR1에 붙으면 Fe-Tf-TfR1의 복합체가 형성되고 클라트린(clathrin) 단백에 의해 둘러싸인다. 이 단백은 복합체를 포매하여 세포막이 안으로 함입되게하여 clathrin이 덮인 엔도솜(endosome)을 형성한다. 그다음 clathrin 단백이 제거되면 endosome 내용물은 ATP 의존 양자펌프로 양자내입이 일어나 산성상태가 된다. 산성 상태에서는 Tf와 TfR1의 구조변화가 일어나 철이 복합체에서 떨어져 나온다. 유리된 3가 철은 철환원효소(ferrireductase) STEAP3 단백에 의해 2가 철로 환원되고, 2가 철은 DMT1을 거쳐 endosome 밖으로 운반되어 직접 이용되거나 저장된다. 최종적으로 Apo-Tf-TfR1은 세포막으로 다시 이동되고 세포외액의 pH 7.4 때문에 Apo-Tf와 TfR1의 친화력이 약해져 Apo-Tf가 유리되고 혈액 속으로 되돌아가게 된다. 그러면 Apo-Tf와 TfR1이 재사용되는 것이다. 조혈모세포가 에리스로포이에틴(erythropoietin) 호르몬에 의해 적혈구전구세포로 분화되면서 적혈구 조혈은 시작된다. 그러나 혈색소 생성은 적혈구전구세포가 적아구로 분화될 때 TfR이 발현되고 철을 취하게 되면서 시작된다. 10. 햄 생성과정헴 생성의 처음과 마지막 단계는 미토콘드리아에서 이루어지지만 중간과정은 세포질에서 일어난다. 첫 단계는 속도제한 과정으로 ALA-synthetase의 촉매에 의해 glycine과 succinyl coenzyme A가 δ-aminolevulinic acid (ALA)를 형성하는 것이다. 비타민 B6 (pyridoxine)는 이과정의 조효소로 erythropoietin에 의해 자극되고 헴으로 억제된다. 생산된 laevulinate는 세포질로 내보내지고 2개의 ALA분자가 농축되어 porphobilinogen (PBG)이 된다. PBG 4분자가 모여 hydroxymethylbilane (HMB) tetrapyrrole macrocycle을 형성하고 이것이 uroporphyrinogen III가 된다. 헴생성의 최종 단계는 porphyrinogen IX이 산화되어 protoporphyrin IX이 되는 것이다.
한편 mitoferrin-1이란 철 운반체가 철이 미토콘드리아로 들어가는 것을 촉진시킨다. 철결합효소(ferrochelatase)는 이합성 과정의 마지막 단계를 촉매하는데 철을 protoporphrin IX에 삽입하여 헴을 형성한다. 그 다음에 헴이 미토콘드리아 헴유출자를 거쳐 세포액(cytosol)으로 유출되고 글로빈쇄와 합쳐져 혈색소(hemoglobin, Hb)를 완성한다. 세포분열이 계속되면서 핵이 농축되어 소실되면 망상적혈구가 되고 결국 세포에 남아있는 RNA도 소실되면 적혈구가 된다. 세포 종류에 관계없이 미토콘드리아는 세포내에 있는 대부분의 철을 소모하는 세포 소기관이고 세포내 철 대사를 조절하는데 중심 역할을 한다. 11. 골수의 철 대사 이상철부하빈혈(iron-loading anemia)은 유전성 뿐 아니라 후천성으로도 발생할 수 있고 비효율적인 적혈구형성과 헵시딘 저하, 철 과다흡수 등으로 철부하가 발생하는 것이 특징이다. 철적모구빈혈(sideroblastic anemia)과 저등급 골수형성이상증후군 등이 비효율적인 적혈구형성에 의한 철부하빈혈의 예이다. 철적모구빈혈에서는 말초혈액도말표본에서 저색소적혈구를 관찰하고 골수도말에서는 철 과다와 고리철적혈모구(ring sideroblast)를 관찰할 수 있다. 고리철적혈모구는 철적모구빈혈의 진단적 소견으로 비정상적인 헴 합성으로 철이 적혈모구의 핵주위 미토콘드리아에 고리모양으로 축적된 것이다. 후천 철적혈모구빈혈의 원인질환은 골수형성이상질환, 골수증식질환, 골수성백혈병, 아이소나이아지드 등 약물, 알코올오용, 연중독 등이다. 또한 철적혈모구빈혈은 류마치스관절염, 악성종양, 대구성빈혈, 용혈빈혈등에서 이차적으로 발생할 수 있다. 12. 비장과 철 대사적혈구수명은 약 120일 이다. 골수에서 하루에 약 200조 개의 적혈구가 생산되고 24 mg의 철이 헴합성과 적혈구 조혈에 쓰인다. 매일 장에서 1 - 2 mg의 철을 흡수하는 것만으로는 하루 소요량 24 mg의 철을 보충할 수 없으므로 비장 대식세포에서 적혈구를 포식하여 적혈구의 철을 순환시켜 재사용하여야 한다. 혈청철의 80%는 세망내피계(reticuloendothelial system, RES)에서 골수로 간다. 따라서 비장은 철 대사에서 주요한 장기이다. 비장이 철 재사용의 주장소이고 간과 골수에서 일부 이루어진다. 세망내피계의 다른 역할은 철 과잉일 때 철을 저장하는 것이다. 나이든 적혈구는 나이든 표지를 보인다. 적혈구막의 유연성이 감소되고 세포막에 phosphatidylserine이 나타난다. 이런 변화를 비장의 포식세포가 인지하여 적혈구를 포식한다. 포식된 적혈구는 포식용해소체(phagolysosome)에 포함되고 가수분해효소와 활성산소에 의해 붕괴되고 헴이 유리된다. 그 후 산소의 존재하에서 HO-1 효소는 헴의 파괴를 촉매하여 철과 일산화탄소(CO), 빌리버딘이 되게 한다. 이에 따라 2가 철은 포식용해소체 밖으로 나가서 세포질에서 불안정 철풀이 된다. 주로 적혈구 포식작용으로 철을 섭취하지만 비장과 그 외 세망내피계는 또 다른 과정으로 철을 얻기도 한다. 정상상태에서도 혈관 내에서 약간의 적혈구가 파괴된다. 이때 유출된 혈색소는 합토글로빈과 결합하여 혈색소-합토글로빈 복합체를 만들고 이는 혈색소의 산화성 활동을 억제한다. 단구나 대식세포 특히 비장과 간에 있는 이들 세포는 CD163단백 수용체를 가지고 있어 혈색소-합토글로빈 복합체를 인식하여 이들과 높은 친화력으로 붙는다. 이복합체를 세포내로 섭취하여 대식세포 안에서 이복합체가 붕괴되면 혈색소가 유리된다. 용혈빈혈이나 지중해빈혈에서와 같이 용혈이 심하면 합토글로빈이 혈색소로 포화되고 자유혈색소가 순환혈액에 있게 된다. 그러면 일부는 붕괴되어 당단백인 헤모펙신에 붙어 헴-헤모펙신 복합체가 된다. 대식세포 등 여러 세포들은 low-density lipoprotein receptor related protein (LRP/CD91)이 헴-헤모펙신 복합체의 수용체가 되어 세포내 섭취가 일어나 철 재활용에 기여한다. 대식세포의 철이 FPN1을 거쳐 순환혈액으로 유출되는데 이는 십이지장 장세포에서 유출되는 철과 같다. 유사하게 대식세포에서 철이 유출되는 과정은 헵시딘에 의해 조절된다. 혈액으로 유출된 2가 철은 세룰로프라즈민에 의해 산화되어 3가 철이 되어 Apo-Tf와 결합하여 재순환하게 된다. 대식세포 세포질의 철은 페리틴으로 저장될 수 있다. 헤모시데린은 정상상태에서는 인체 철의 극히 적은 양으로 일차적으로 대식세포에만 있으나, 세포내 철이 증가하면 더 많은 철이 헤모시데린이 된다. 철부하상태면 과잉 철은 헤모시데린이 되어 세포가 부피에 비하여 더 많은 철을 저장할 수 있게 한다. 철부하상태에서는 대식세포의 헤모시데린이 증가하는데 이는 안전성 면에서 의미가 있어 대식세포의 이런 형태의 철저장은 산화손상을 예방한다. 13. 비장관련 철 대사 이상유전성빈혈과 골수의 적혈구 조혈부전 환자에서 정기적인 수혈이 유일한 치료법이다. 수혈된 적혈구는 비장과 그 외의 세망내피계의 대식세포에게 포식되고 파괴된다. 그러면 철이 유리되어 혈액으로 들어가 재사용된다. 그러나 반복되는 수혈과 적혈구 탐식으로 비장 등 세망내피계가 많은 철을 혈액으로 유출하면 철 부하상태가 된다. 트랜스페린의 철결합능은 포화되고 혈장에 트랜스페린 미결합철(transferrin-bound iron, NTBI)이 나타나면 활성산소가 생산되어 장기가 손상된다. 선천혈색소침착증(hereditary hemochromatosis)과 만성질환빈혈은 비장과 장을 포함한 여러 장기에서 철 대사의 장애가 일어난 대표적인 질환이다. 두 질환 모두 헵시딘 수치가 비정상이다. 요점은 헵시딘이 FPN1을 낯추어 세망내피계와 장에서 철이 혈액으로 유출되는 것을 줄인다. 선천혈색소침착증에서는 헵시딘 수치가 낮아져 FPN1이 상향 조절되어 세망내피계 대식세포와 장에서 흡수된 철의 양을 증가시킨다. 반대로 만성질환빈혈에서는 헵시딘 수치가 증가되고 FPN1이 하향 조절되어 장에서 철 흡수가 감소되고 비장과 간의 대식세포에서 철 유출을 억제한다. 14. 간에서의 철 대사간에서의 철 대사 간은 철 대사에 관여하는 많은 단백질을 생산하기 때문에 철 대사에서 매우 중요한 기관이다. 무엇보다도 철 항상성유지에 절대적인 조절 물질인 헵시딘을 생산하는 기관이다. 헵시딘은 철항상성의 주된 역조절물질(negative regulator)이다. 헵시딘은 철유출에 관여하는 FPN1 단백에 붙어 내재화시켜 리소좀에서 분해되도록 한다. 이렇게 FPN1을 하향 조절하여 철이 혈액으로 들어가지 못하게 한다. FPN1의 이런 역조절로 장에서는 철이 장세포안에 갇히게 되어 혈액으로 유출되는 철의 양이 적게 되면서 더 많은 철이 장세포에 머물다가 탈락으로 소실된다. 세망내피계에서 철이 대식세포의 적혈구 탐식으로 먹혀 세포 안에 갇히게 되고 FPN1에 의해 혈액으로 유출되는 것을 헵시딘이 막은 상태가 된다. 정상 생리 상태에서는 인체 철이 정상 농도를 유지하도록 헵시딘의 발현을 치밀하게 조절한다. 철농도가 높으면 헵시딘 합성이 증가되어 장에서 철 흡수와 세망내피계의 대식세포에서 철이 혈액으로 유출되는 것을 줄여 철 농도를 정상으로 유지한다. 반대로 철결핍 상태에서는 헵시딘 생산이 감소되어 장에서 철 흡수가 증가되고 세망내피계에서 유출되는 철의 양을 증가시켜 혈액의 철을 증가시킨다. 빈혈이나 적혈구조혈이 활발한 상태에서는 헵시딘 발현이 억제되어 전신의 철을 증가시킨다. 간세포막에 있는 많은 단백질들이 철농도의 감각기 역할을 하여 헵시딘 합성 양을 조절한다. 조절하는 경로 중의 하나는 hemojuvelin-bone morphogenic protein (HJV-BMP) 경로인데 bone morphogenic protein 6 (BMP6)는 이 경로에 관여하는 BMP들 중 하나이다. BMP6는 간의 비실질 간세포(굴내피세포, 간별세포, 쿠퍼대식세포)를 통해 헵시딘을 생산한다. 인체 철 농도가 높아지면 비실질 간세포에서 BMP6 합성이 증가하고 결국 더 많은 BMP6가 BMPR-HJV 복합체에 결합하여 더 많은 헵시딘을 생산하게 된다. 혈액의 철 농도가 증가하면 헵시딘 유전자인 HAMP 발현을 유도하여 헵시딘을 증가시켜 철 농도를 낮춘다. 감염과 염증은 헵시딘 합성을 증가시킨다. 이는 인체의 방어기전의 하나이다. 철농도가 낮아지면 철을 필요로 하는 세균의 생장이 장애를 받고 감염은 급격히 완화된다. 면역시스템이 병균에 노출되면 염증 세포에서 사이토카인이 유출된다. 이중의 하나가 인터루킨-6 (interleukin-6, IL-6)이다. IL-6는 간세포막에 있는 수용체에 의해 인지되고 이로 인해 janus kinase를 활성화 시켜 HAMP 전사를 자극하여 헵시딘을 생산토록 한다. 그래서 만성감염질환이나 염증질환, 암 등에서는 헵시딘 농도가 지속적으로 상승되어 있다. 이는 세망내피계 대식세포의 철을 세포 안에 격리 잔류시킬 뿐 아니라 장에서 철 흡수를 장기간 감소시킨다. 그래서 골수에서 이용할 철이 줄어들어 만성질환빈혈이 발생한다. 간은 중요한 철 보관 장기이다. 혈액에서 트랜스페린 결합 철(TBI), 비결합철(NTBI), 페리틴, 혈색소-합토글로빈 복합체, 헴-헤모펙신 복합체 등을 취하여 저장한다. 철 항상성이 유지 될 때는 과부하 철은 간세포에 페리틴으로 저장되나 철이 부하 양이 많으면 철이 헤모시데린으로 저장된다. 철 과부하가 오랫동안 지속되면 페리틴과 헤모시데린이 높은 농도로 축적되고 이들이 리소좀에서 분해되면서 3가 철이 2가 철로 환원되어 리소좀에 2가 철 농도가 높아진다. 이때 생리적으로 만들어 지는 과산화수소는 생물학적 막을 통과할 수 있어 리소좀 구획 안으로 들어가면 상승 상태의 2가 철과 펜톤 반응(Fenton’s reaction)을 일으켜 활성산소기(reactive oxygen species, HO-, HO 등)를 다량 발생한다. 이 수산화기는 리포좀 막을 터트리고 나가 세포질로 유출되어 간세포 손상과 괴사를 일으킨다. 철부하가 지속되면 간은 철의 주저장소가 되고 오래 지나면 간경변과 간세포암 발생의 위험이 커진다. 간추리면 세포내 철의 균형기전은 철 대사 관련 단백의 mRNA의 안전성과 유전자 부호해독을 조절하는 것이다. 철결핍에서는 iron regulatory proteins (IRPs)이 mRNA-Iron responsive element (IRE)에 붙어 페리틴을 제외한 철 관련 단백(Tf, TfR1, DMT1, ALA 합성효소)의 합성을 증가시킨다. 이로 인하여 장의 철 흡수가 증가되고 트랜스페린과 트랜스페린수용체의 증가로 세포들이 혈액으로부터 철을 더 많이 흡수한다. 반대로 페리틴을 감소시켜 철 저장을 억제한다. 전체적으로 이런 변화는 세포의 철 이용을 증가시킨다. 이와 대조적으로 세포 철이 과잉이면 IRE에 대한 IRP 부착 용량이 상실되어 mRNA가 분해되고 철 관련 단백질의 합성이 저하된다. 결과적으로 장의 철 흡수가 감소되어 TfR1에 의한 혈액으로 철 유입이 감소되면 세포내 부하 철은 페리틴으로 저장된다. 15. 간 관련 철 대사 질환차 또는 선천혈색소침착증(hereditary hemochromatosis, HH)은 철과잉과 철 상태에 맞지 않는 헵시딘 저하 등 특징적인 소견을 보인다. HH에는 여러 가지 유형이 있다. I 형은 HFE 유전자 변이에 의한 것이고, II 형은 HJV 유전자 변이, III 형은 TfR2 유전자변이에 의한 것이다. 이들 모든 형에서 간의 헵시딘 생산이 저하되어 ferroportin의 농도가 높아져 장의 철 흡수가 증가하고 세망내피계 대식세포의 철농도가 낮아지고 트렌스페린 포화도가 증가하고 혈액에 활성 NTBI가 나타난다. 그러면 간에 철부하가 일어나고 간의 손상, 괴사, 섬유화가 일어날 수 있다. HH IV형 페로폴틴병(ferroportin disease, FD)은 보통 상염색체우성 유전 철 부하병으로 FPN 유전자의 이형접합체변이로 발생한다. 이차혈색소증은 의료적인 원인으로 2차적인 철과부하가 발생하는 경우이다. 주지중해빈혈(thalassemia major), 재생불량성빈혈(aplastic anemia) 같은 경우에 만성수혈 치료로 철과부하, 과잉 철저장이 발생하면 간 심장 등 철 저장 장기에 손상이 발생한다. 더구나 알코올중독, 바이러스간염 등 만성간질환이 있으면 간의 헵시딘 합성이 손상된다. 헵시딘이 저하되면 장의 철 흡수가 증가하고 철부하가 와서 간이 손상된다. 16. 세포내에서의 철 흐름과 저장3가 철만이 세포질 또는 미토콘드리아로 운반된다. 따라서 철환원효소가 2가 철을 3가 철로 산화시켜야 한다. 철은 독성 때문에 세포질 내에서 철의 샤프롱 역할을 하면서 페리틴에 철을 운반하는 poly(RC)-binding protein 1 같은 단백질과 연계되어야 한다. 페리틴 분자 안에서 철은 수산화물이나 인산염과 연결되어 3가 철 형태로 저장된다. 각 페리틴 분자는 4500 개 철 이온을 붙들고 있다. 페리틴은 혈청에도 있고 철 과부하나 염증 시에 상승한다. 대식세포의 페리틴 철은 세포 자신의 대사 작용에는 별로 쓰이지 않는다. 페리틴의 유전적 변이는 몇몇 신경질환과 관계가 있다. 지난 수십년간 페리틴은 인체의 철 상태를 나타내는 지표로 사용되어 왔다. 적혈구계 세포들은 다른 세포보다 더 많은 철을 필요로 하고 모두 트랜스페린 수용체 1을 통해 얻는다. 미토콘드리아로의 철 운반은 mitoferrin 1에 의해 이루어진다. mitoferrin 1에 의해 철을 들여와 철결합효소(ferrochelatase)에 의해 철을 결합시켜 헴을 생합성하게 한다. 적혈구계 세포는 철결핍상 태에서 소적혈구가 되는 등 철결핍에 적응할 수 있는 기전을 갖추고 있다. 철결핍 상태가 되면 전사단계(transcription level)에서 페리틴 생산을 억제하여 페리틴을 감소시켜 저장 철을 줄여 혈청철이 더 감소되지 않게 한다. 철이 감소되면 iron regulatory protein 1 & 2 (IRP1 & IRP2)이 iron responsive elements (IREs)에 붙는다. 이 IREs는 페리틴과 ferroportin 유전자의 5’UTR에 있는데 여기에 IRP2가 붙으면 전사가 억제되어 페리틴의 생산을 억제해 혈액에서 철이 필요 없이 나가는 것을 막아 철이 감소되지 않게 한다. 반대로 TfR1과 일부 DMT1 변이형은 3’UTR에 IRE가 있어 철결핍시 IRP2가 여기에 붙으면 mRNA를 안정화 시켜 세포로 철 유출에 관여하는 TfR1, DMT1 생산을 보완하고 세포내 철을 안정화시킨다. 17 철 대사에 관여하는 단백의 유전 다형성철 대사에 관여하는 단백에도 유전 다형성이 보고되었으나 철 결핍이나 철 과부하와의 관계는 확인되지 않았다. 인간에서 GWAS (genome wide association studies)로 여러 가지 SNP와 철 대사의 상관성이 밝혀졌다. 강력한 항산화 기능과 관련있는 MT2 (metallothionein 2) 유전자 다형성과 철결핍빈혈이나 제2형 당뇨병 발생위험과 관련이 있음이 확인되었다. 트랜스페린 유전자와 HFE 유전자(Human homeostatic iron regulator protein의 유전자)의 SNP가 철결핍빈혈과 관련이 있음도 확인되었다. 18. 맺음철은 필수 미량 영양소로 생명유지에 필요하다. 인체가 철을 배설하는 기전을 갖추고 있지 않다는 것은 인류사 이전부터 인간은 일정한 철 섭취를 할 수 없음을 추정하게 한다. 철 대사는 인체에서 소화기(장), 골수, 비장, 간 등 여러 장기와 조직이 관련된 아주 복잡한 과정으로 이루어진다. 철의 항상성 유지는 헵시딘이라는 주조절단배질 등 많은 단백질이 관여한다. 간에서 생산된 헵시딘은 음성되먹임 기전으로 철 농도를 조절하고 헵시딘 합성은 철 농도, 빈혈, 감염, 염증, 적혈구 조혈 등에 의해 조절된다. 세포 철의 균형 기전은 IRP와 IRE 상호작용에 의해 이루어진다. 철 대사에 관여하는 조직에서 발생하는 질병 상태는 철 항상성 조절기능에 장애를 초래한다. 이 질환들은 결국 철 결핍이나 과잉상태를 초래하여 인체에 해를 끼친다. 감염질환에서 불안정 철과 염증상태는 독성 산소라디칼의 농도를 높이고 산화스트레스로 여러 조직과 장기에 세포 손상으로 병을 일으킨다. 우리나라 가임여성의 약 8%가 철결핍빈혈 환자이고 이들 중에 혈색소 5 g/dL이하로 심한 빈혈을 가지고 일상생활을 어렵게 하고 있는 환자도 드물지 않게 볼 수 있다. 이들의 적혈구를 현미경으로 관찰하면 혈색소가 적어 허옇게 보이고 찌그러지고 조각으로 갈라져 있기도 한다. 병 중에 비교적 치료가 쉬운 철결핍빈혈이 빈발하는 현실이 22세기 선진국에 진입했다는 나라에서 이해가 되지 않는다. 필자의 판단은 의사들이 철결핍빈혈을 별것 아닌 질환으로 취급하고 여성분들도 참을 만한 질환으로 여기는 잘못된 인식 때문일 것이다. 철 대사 질환이 무시할 수 있는 질환이 아니고 수많은 인체의 기능과 연결되어 장기적으로 큰 피해를 줄 수 있는 질환으로 인식 전환이 필요하다. 최근 많은 연구에 의해 철 대사기전이 밝혀졌지만 아직도 많은 의문이 남아있다. 앞으로 철 관련 질환의 병태 생리에 대한 기전이 밝혀지고 치료법이 개선되어 철결핍빈혈로 혈색소가 5.0 g/dL이하로 감소되는 환자들이 없게 되길 기대한다. 참고문헌:
|
Copyright © The Korea Society for Laboratory Hematology. All Rights Reserved.
|